АгроСборник.Ру
С.Ф. Коваль, В.П. Шаманин "Растение в опыте"
Она допускает быстрое (безинерционное) изменение режимов минерального питания или засоления путем замены раствора в сосуде, а также визуальное наблюдение корней, измерение их активности. Она дает возможность извлечь растение из культивационного сосуда для обработки физиологически активными веществами, мутагенами или для облучения.
Главной трудностью при использовании водной культуры является снабжение корней кислородом. Непрерывная аэрация раствора сжатым воздухом или интенсивное его перемешивание делает эксперимент громоздким, часто увеличивает неравномерность условий по сосудам. Периодическая (несколько раз в сутки) аэрация не дает эффекта, так как в прилегающем к корням слое раствора кислород исчерпывается за 30 мин, а его поступление из основной массы раствора происходит слишком медленно по причине крайне низкой скорости диффузии газов в воде. Нарушение аэрации приводит к снижению интенсивности поглощения корнем питательных веществ. Внешний вид растения при этом напоминает картину затопления в почвенной культуре или на начальных этапах азотного голодания. Сходство обусловлено тем, что во всех этих ситуациях первые по времени изменения вызваны недостаточным поступлением в корни азота. Только позднее наступает отравление корней продуктами анаэробного дыхания. Верхние листья бывают узкими, бледно-зелеными, круто поднятыми вверх, нижние - бледно-зеленые с оттенком желтизны (особенно на концах), все растение приобретает характерный «камышс-нидный» облик. Позднее нижние листья желтеют (начиная с верхушки) и отмирают, рост резко замедляется, урожай семян падает даже- н случае восстановления нормальных условий. При крайней степени такого повреждения на растении остается не более 2 листьев, нижний из которых быстро отмирает с появлением нового листа.
Количество поглощенных из раствора ионов (М) зависит от числа контактов иона с мембраной клетки, т.е. от концентрации раствора (К), от активного поглощения, выражающего долю поглощенных ионов от общего числа контактов (е), и, наконец, от размеров поглощающей поверхности корня (S):
М = eKS
Наращивание поверхности корней в условиях дефицита кислорода невозможно. Поэтому снижение активного поглощения ионов из-за дефицита макроэргов АТФ следует компенсировать увеличением концентрации питательного раствора до 2-3-кратной. Практически эта задача может решаться выращиванием растений в неглубоких сосудах на более концентрированном растворе. Концентрированные питательные растворы подавляют рост корней и тем самым сокращают их потребность в кислороде. С другой стороны, сильное подавление роста корней у молодых проростков нежелательно, так как последние получаются слишком короткими и при понижении уровня раствора теряют контакте ним. При высадке растений в сосуд мы даем в начале 0,1-0,5- кратную концентрацию, через 5-7 дней повышаем ее до однократной и только позднее, при достижении корнями нужной длины, доводим раствор до 2-3- кратной концентрации. Следует иметь в виду, что в концентрированных растворах значительная часть двухвалентных катионов и фосфора выпадает в осадок, а значит, может возникнуть голодание по этим элементам, если не менять раствор достаточно часто.
Последнее замечание о минеральном питании касается внесения железа и микроэлементов. Приводимые в прописях количества явно недостаточны по причине выпадения их в осадок в виде фосфорнокислых солей. В нашей практике вносится в раствор количество микроэлементов, в 20-50 раз превышающих рекомендованное в литературе. Еще лучше вносить их не только в раствор, но и в виде внекорневых подкормок. Только в этом случае нам удавалось предотвратить появление на пшенице признаков голодания по железу и меди.
При большом объеме опытов удобно пользоваться заранее приготовленным маточным раствором, который в необходимом количестве разводится перед употреблением. При приготовлении маточного раствора в одном объеме все элементы, кроме калия и азота, выпадают в труднорастворимый осадок. Поэтому маточный раствор 100-кратной концентрации следует готовить в 2 бутылях, отделяя фосфорнокислые соли от соединений кальция и магния. Полная питательная смесь получается при совместном разведении 2 растворов, которые отмериваются в равных объемах. Прописи питательных растворов различного назначения приведены в приложении. Выбор экспериментатором того или иного из них будет зависеть от поставленной задачи и в не меньшей степени от избранного растения. Все сказанное выше о питательных растворах в водной культуре в равной степени относится и к опытам в проточной культуре и в гидропонике, где эти вопросы специально не излагаются.
Существует много способов закрепления растений в сосуде [Клейн, Клейн, 1974]. Нами применяется закрепление полосками поролона на рамках (сепараторах), вставляемых в прямоугольный сосуд из винилпласта или нержавеющей стали. Проростки, предварительно выращенные в рулончиках, сортируются по размеру и раскладываются поперек полосы поролона, которая по длине равна щели сепаратора и в 1,5 раза шире ее. Дальнейший порядок зарядки сепаратора показан на рисунке 5.3. Зерновки высаженных проростков злаков находятся ниже поролона, т.е. в воздушном пространстве между сепаратором и поверхностью раствора. Проростки двудольных погружают в сепаратор до семядолей, а у гороха семя зажимают в поролоне.
Модификацией описанной конструкции являются разработанные нами кассеты для молодых растений (рис. 5.4.). Они более удобны для мелкосемянных культур (люцерна, свекла), но могут с успехом применяться и для средне- и низкорослых сортов зерновых злаков. Собранная кассета с 3 рядами растений помещается в противень с тонким (3-5 см) слоем питательного раствора. При достаточном освещении такая светолюбивая культура как пшеница хорошо развивается и вызревает в кассетах. Аэрация при этом обеспечивается малой глубиной слоя раствора. Как в крупных сосудах, так и при выращивании в кассетах замену питательного раствора следует производить через 2 дня, а с начала цветения - через 4 дня.
В заключение отметим, что водная культура является наиболее сложным видом эксперимента, в котором все условия питания отданы в руки его организатора, а успех в наибольшей степени зависит от его опытности.
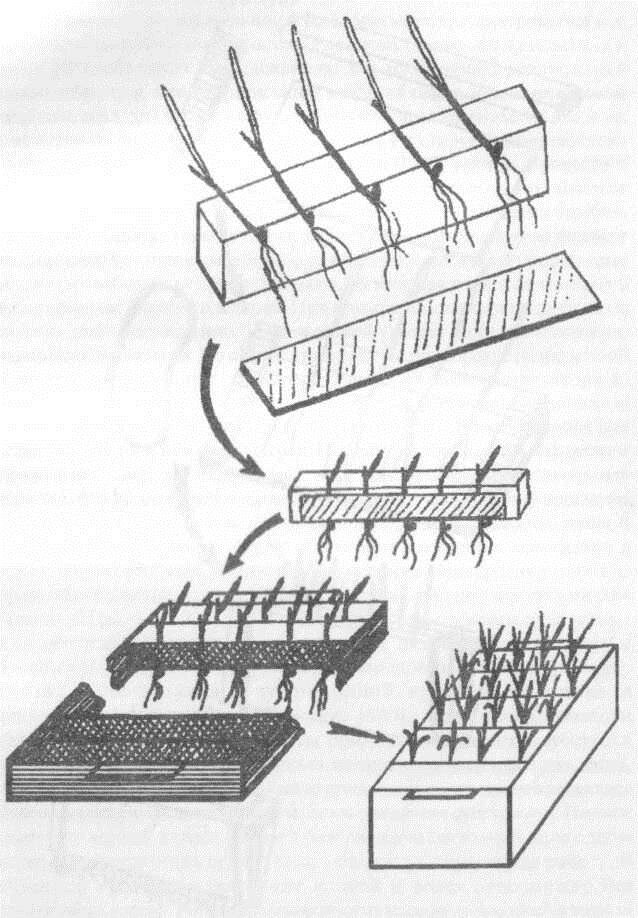
Р и с. 5.3. Способ крепления растений в водной культуре
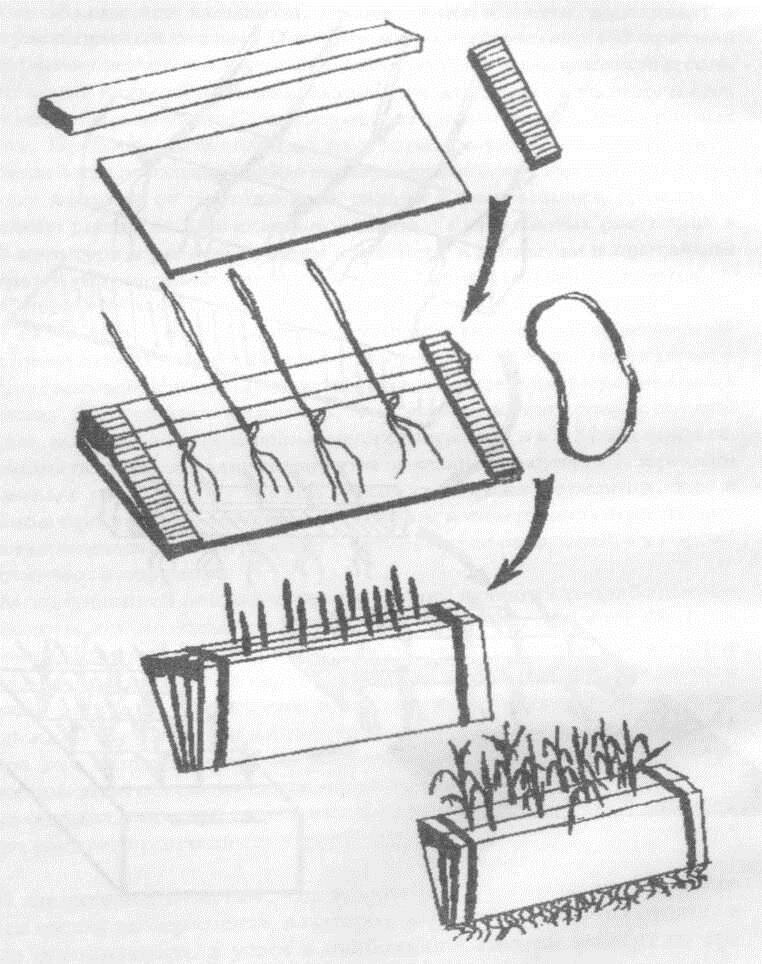
Рис. 5.4. Выращивание проростков в кассетах
Поделиться!
Понравилась статья? Расскажите о ней знакомым или оставьте комментарий!
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Вы можете оставить свой комментарий авторизовавшись при помощи любой из представленный социальных сетей: