АгроСборник.Ру
Определение распространенности и развития дитиленхоза на клубнях картофеля проводится методом клубневого анализа через 3-4 недели после уборки и за 30-40 дней до посадки. От каждой партии картофеля, заложенного на хранение, массой до 10 т отбирается образец в 200 клубней не менее чем из 10 различных мест партии с тем, чтобы он отражал среднее ее состояние. При большей массе партии на каждые следующие 10 т дополнительно отбирается по 50 клубней не менее чем из четырех мест. В каждом месте берется подряд без выбора одинаковое число клубней.
Клубни тщательно отмываются в воде, а затем ножом снимается тонкий слой кожуры. Наличие стеблевой нематоды определяется визуально, микропрепарированием, а в сомнительных случаях вороночным методом с последующим осмотром осадка под микроскопом или бинокуляром. Количество поврежденных клубней выражается в процентах.
При вороночном методе, предложенном Шепшелевым (1968), анализируемый клубень измельчается ножом на мелкие кусочки (4-5 мм) и кладется на сетку из капроновой ткани или марли, находящуюся в воронке с резиновой трубкой, на свободный конец которой надевается пробирка, или трубку зажимают. В воронку заливают воду, нагретую до 25-300С. Под действием теплой воды в течение 4-5 часов нематоды выходят из тканей растения и оседают на дно.
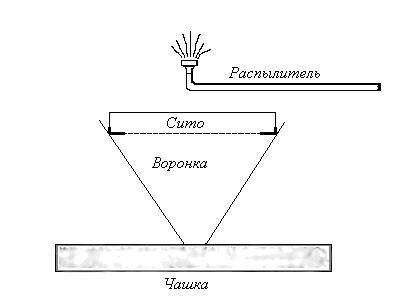
Для выделения подвижных форм нематод, в том числе дитиленхов, может использоваться также дождевальный метод Сейнхорста (1950). Предназначенные для исследования части растений помещают на сито, которое ставят в широкую воронку, и смачивают водой из находящегося сверху распылителя. Воронка поставлена в плоскую чашку (рис. 1).
Нематоды покидают растительный материал и попадают вместе с капающей водой в чашку. Избыточная жидкость переливается через край, не захватывая нематод, так как скорость подъема воды в чашке для этого слишком мала.
Рисунок 1 - Метод Сейнхорста.
Вороночно-дождевальный метод Остенбринка (1960) является комбинацией вороночного метода Бермана с дождевальным методом Сейнхорста. Растительный материал (около 10 г.) ложится на сито с ватным фильтром в воронку Бермана. Из душа на сито подается около 100-500 см3 воды в час. Поддержание подачи именно этого количества воды важно, так как при превышении его возможна потеря нематод с вытекающей из воронки водой.
Целесообразно под один душ помещать несколько воронок. Этот нематод пригоден для извлечения нематод из коней, листьев и стеблей. Для обеспечения полного выхода нематод растительную массу нужно обрабатывать водой в течение нескольких дней.
Через каждые 2 дня подвижных нематод следует спускать из воронки.
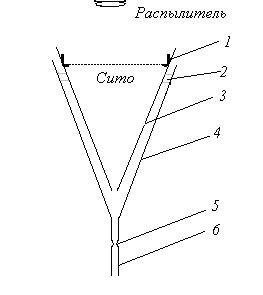
Для выделения можно использовать метод двойных воронок по Хомейеру. Для этого применяются две вставленные одна в другую воронки (рис. 2). Предназначенный для исследования растительный материал помещают, как и в ранее описанных методах, на сито с ватным фильтром. Сито вставляют во внутреннюю воронку и опрыскивают. Нематоды оседают на дно воронки, в то время как бактерии и избыток воды вытекают через край наружной воронки. Здесь также должна соблюдаться подача определенного количества воды, чтобы не терялись мелкие нематоды. Примерно за полчаса до отбора нематод опрыскивание прекращают, чтобы нематоды могли осесть. Части листьев и стеблей должны опрыскиваться около 6 час., корни – не менее 12 час. Следует отметить, что при такого рода коротких экспозициях можно извлекать лишь подвижных нематод. Яйца остаются в растительном материале.
Рисунок 2 - Метод двойных воронок Хомейера.
1 – зажимающее кольцо; 2 – держатель; 3 – внутренняя воронка; 4 – наружная воронка; 5 – зажим на шланге; 6 – шланг.
При явных признаках заражения клубней для окончательного диагноза наличие стеблевой нематоды используют метод среза. Для этого на границе здоровой и поврежденной части клубня срезают или соскабливают кусок ткани и помещают на предметное стекло в каплю воды. Затем через покровное стекло, просматривают под микроскопом.
Исследования почвы на присутствие фитогельминтов, помимо необходимых технических средств, требуют знания видов нематод, встречающихся в почве. Наряду со стеблевыми нематодами, в почве встречаются мигрирующие корневые нематоды (Pratylenchus, Paratylenchus, Tylenchorhynchus, Trichodorus, Xiphinema и др.) листовые нематоды и бесстилетные формы.
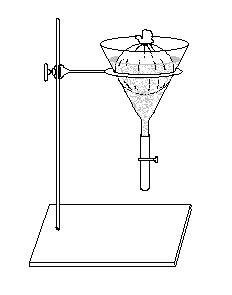
Наиболее старым и в тоже время наиболее простым методом выделения фитопаразитических нематод из почвы является вороночный метод Бермана (Baermann, 1917) (рис. 3). Оборудование состоит из воронки диаметром 10-15 см. и углом наклона не менее 500, а также резинового шланга, надеваемого на трубку воронки. На нижний конец трубки надевают зажим Мора. Пробу почвы в марлевом мешочке помещают в воронку которую наполняют водой так, чтобы вода покрывала пробу. Подвижные нематоды выходят через марлю в воду и собираются в сужении воронки. При открытии зажима около 10 см3 воды с нематодами сливают в чашку Петри, где производят определение и подсчет. Однако этот метод имеет ряд существенных недостатков. Нематоды, находящиеся в пробе могут плохо выходить в воду. Кроме того, мелкие частицы почвы также попадают сквозь марлю в трубку воронки и в последствии затрудняют подсчет. Поэтому этот метод претерпел ряд изменений. Вместо марлевого мешочка можно использовать перлоновое сито с уложенным на него одним ватным фильтром для процеживания молока, куда помещается 10 см3 исследуемой почвы. Воронка заполняется водой таким образом, чтобы почва увлажнялась снизу. Через 3 дня почти все нематоды выходят из почвы и находятся в стоке воронки над зажимом. При исследовании богатых гумусом почв экспозицию следует удлинить до 6 дней.
Рисунок 3 - Метод Бермана.
Вместо воронок можно использовать поддон с ситом. Почвенную пробу помещают на покрытое ватным фильтром сито и ставят в заполненную небольшим количеством воды плоскую чашку. Нематоды большей частью за 24 часа выходят в воду, которую сливают в мерный цилиндр и после оседания нематод избыточное количество воды отсасывают пипеткой. Остаток переливают в чашку.
Помимо простого метода Бермана существует ряд более сложных методов основанных на принципе противотока, препятствующего оседанию более легких почвенных частиц и нематод. Сюда относятся методы, использующие колбы Эрленмейера, аппарат Остенбринка или отмучивающий аппарат Сейнхорста (Деккер, 1972).
В ряде случаев под покровным стеклом можно наблюдать нематод разных видов, в том числе различных сапробионтов (преимущественно из родов Rhabditis и Diplogaster) и некоторых фитогельминтов. Следует на этот случай для отбора нужных видов иметь слабый раствор метиленовой синьки. После окраски, примерно через 5-7 минут, все сапробионты окрасятся в синий цвет, все нетипичные сапробионты (Cephalobus, Eucephalobus) окрасятся слабо, все фитогельминты не окрасятся совсем. Все погибшие и полуразложившиеся нематоды будут также интенсивно окрашены.
При небольшом увеличении фитогельминтов можно выделить из всех присутствующих разновидностей нематод по характеру движения: они плавные, неторопливые, в отличие от суетливых, резких движений сапробионтов.
Таксономическое деление нематод основано на различиях в их морфологии, биологии и экологии. При идентификации используется ряд промеров для получения относительных характеристик – индексы де Манна. Наиболее приняты следующие:
Кроме того, может производится расчет показателя V, введенного Х.Миколецким. и определяющего положение вульвы на теле самки, а так же индекс Т (отношение длины половой трубки к общей длине тела, %).
В последние годы все большее распространение получают молекулярные методы диагностики возбудителей заболеваний. Такие методы как RFLP (полиморфизм длин рестрикционных фрагментов) (Curran et al., 1985), гибридизации ДНК (Burrows & Perry, 1988), RAPD (случайная амплификация полиморфной ДНК) (Esquibet et al., 1998; Folkertsma et al., 1994; Williamson et al., 1997; Zhang et al., 1998), PCR (полимеразная цепная ракция) (Zouhar et al., 2000) и SCAR (Zijlstra, 2000) используются для идентификации фитопаразитических нематод.
Марек М. и др. (2005) использовал метод амплификации ДНК in vitro (ПЦР) для дифференциации рас стеблевой нематоды Ditylenchus dipsaci (K?hn) Filipjev. Данный метод имеет ряд значительных преимуществ по сравнению с классической морфологической диагностикой:
- высокая специфичность, т.е. в исследуемом материале выявляется уникальный фрагмент ДНК, характерный только для данного возбудителя заболевания,
- высокая чувствительность – метод ПЦР позволяет выявлять единичные клетки даже бактерий и вирусов,
- высокая скорость получения результата, так как для проведения ПЦР-анализа не требуется выделение и выращивание культуры возбудителя. Полный анализ возможно провести в течение 4-4,5 часов.
- возможность диагностики латентной инвазии.
К недостаткам этого метода можно отнести большой процент ложноположительных результатов и высокая стоимость анализа.
Степень поражения клубней картофеля стеблевой нематодой учитывается по следующей шкале:
9 – поражение отсутствует,
7 – 1-10 % площади поражения поверхности клубня,
5 – поражено до 25 % поверхности клубня,
3 – 25-50 %,
1 – >50%,
Распространенность болезни на растениях и клубнях картофеля определяется по общепринятой в фитопатологии формуле:
где: P-распространенность заболевания (%),
n-число больных растений в пробе (шт.),
N-общее число растений в пробе (шт.).
Степень развития дитиленхоза на клубнях вычисляется по следующей формуле:
где: R – развитие заболевания, %;
S(а+в) – сумма произведений количества больных растений, клубней (других органов растения) (а), на соответствующий балл поражения (в);
N – общее число обследованных растений, клубней (других органов растения);
К – наивысший балл шкалы учета.
Читайте также
Поделиться!
Понравилась статья? Расскажите о ней знакомым или оставьте комментарий!
![]()
![]()
![]()
![]()
![]()
![]()
![]()