АгроСборник.Ру
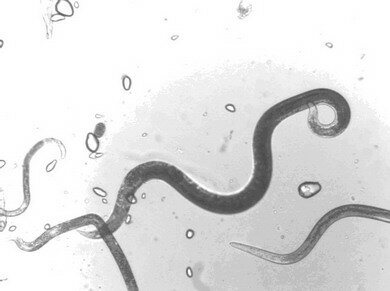
Стеблевая нематода (Ditylenchus destructor Thorne, 1945) относится к типу круглых червей Nemathelminthes; классу Nematoda; подклассу Secernentea (Von Linstow, 1905) Dougherty, 1958; отряду Tylenchida Thorne, 1949; подотряду Tylenchina (Thorne, 1949) Geraert, 1966; надсемейству Anguinoidea (Nicoll, 1935) Siddiqi, 1980; семейству Anguinidae Nicoll, 1935; подсемейству Anguininae (Nicoll, 1935) Paramonov, 1962; роду Ditylenchus Filipjev, 1936 (синонимы – Tylenchus (Chitinotylenchus) Micoletzky, 1922; Chitinotylenchus (Micoletzky, 1922) Filipjev, 1936) (W. Nicoll, 1935; G. Thorne, 1949) (рис.16).
Взрослые нематоды, как самцы, так и самки обладают нитевидным, стекловидно-прозрачным телом, суженым на концах. Личинки по форме похожи на взрослых особей, однако значительно меньше размерами. Яйца - удлиненно-овальные. Тело нематод покрыто кутикулой. Головной конец слегка округлен с небольшим стилетом. Пищевод тонкий, с удлиненно-овальным бульбусом, который имеет радиальную мускулатуру. Средняя кишка состоит из одного ряда клеток и покрыта цельным «жировым телом» (Деккер Х., 1972)
Мускулатура нематоды состоит из мышц, которые образуют мешок веретеновидных клеток, которые связаны с гиподермой по всей длине тела. Благодаря выступающим гиподермальным валикам мышцы подразделяются на тяжи или поля. Специальная мускулатура служит для функционирования органов питания и размножения.
Половые органы: у самок – половая трубка, которая состоит из яичника, яйцепровода и матки, а у самцов - семенник, семенной пузырь и семяпровод. Плодовитость самок зависит от температуры и влажности, от условий питания. Одна самка в среднем откладывает 250 яиц за весь период жизнедеятельности. (Кирьянова Е.С., Кралль Э.Л., 1971).
У нематод рода Ditylenchus после откладки яиц начинается эмбриональный период: первое деление происходит в яйцах через 4-6 ч. после откладки. Под защитой яйцевых оболочек протекает почти весь органогенез нематод и 1-ая линька личинок. Из яиц выходят личинки 2-го возраста (Juksel H.S., 1960; Brun I., Cayrol J.C., 1970).
Нематодам данного рода присуще явление матрицидального отрождения личинок (Endotokia matricida) или внутриматочное развитие яиц (рис. 17). Обычно оно присуще старым самкам, у которых не хватает сил вытолкнуть яйца во внешнюю среду (Luc M., Taylor D.P., Netscher C., 1979; Теплоухова Т.Н., 1968а, 1968б; Филипьев И.Н., 1934). По мнению P. A. Loof (1959) причиной данного явления является большое число яиц в матке и быстрое их развитие.
Как правило, это приводит к гибели материнский организм, поскольку личинки активно двигаются, выходят из полости матки в полость тела самки, где обычно питается внутренним содержимым тела матери.
Развитие и размножение нематод может происходить при температуре от +10 до +370С, но оптимальными условиями являются +20-260С (Устинов А.А., Терещенко Е.Ф., 1959; Anderson R.V., Darling H.M., 1964; Иванова Т.С., Вялых А.К., 1996).
По мнению Х. Деккера (1972) температура сильнее других факторов окружающей среды влияет на развитие нематод, особенно ее нижние и верхние пороговые значения, а также температурный оптимум.
Как указывает Wallace H.R. (1963) верхний предел температуры колеблется не так сильно как нижний.
В литературе существуют сообщения, что стеблевая нематода сохраняет свою жизнедеятельность после двухнедельного промораживания инвазионного грунта, а также свежих клубней при температуре от -180 до -280С (Ладыгина Н.М., 1956).
K?hn (1857) и Cairns (1952) считали, что у видов рода Ditylenchus к анабиозу способны все стадии развития червей. Однако по данным G. Thorne, 1961 Ditylenchus destructor в отличие от D. dipsaci не способен в преимагинальной стадии переживать неблагоприятные условия впадая в анабиоз. Перезимовка у них происходит в стадии яйца. Промерзание почвы яйца переносят без ущерба (А.А. Устинов, Е.Ф. Терещенко, 1959).
А.А. Парамонов и Ф.И. Брюшкова (1956) установили, что скорость развития одной генерации стеблевой нематоды картофеля достигает от 15 до 45 дней. Развитие дитиленхов в клубнях при температуре +22-240С занимает приблизительно 24 дня.
Подвижность нематод зависит от насыщенности среды обитания кислородом. В опытах Ладыгиной (1957) стеблевые нематоды D. destructor и D. dipsaci замедленно двигались в воде, насыщенной О2 на 16-17%, а при 6% - становились неподвижными.
На подвижность нематод оказывает также влияние физиологическое состояние тканей растения-хозяина. Наблюдается корреляция между интенсивностью окислительного метаболизма растительной ткани и подвижностью дитиленхов (Костюк, 1979). В некротизированных участках растительной ткани нематоды (D. destructor) малоподвижны (Криводубская, 1978).
Устойчивость к высыханию и избыточной влажности у D. destructor зависит от почвенных условий. В условиях низкой влажности активность нематод уменьшается, однако это не означает, что они погибают.
Г.Н. Линник и А.И. Басова (1954) в лабораторных условиях наблюдали гибель стеблевой нематоды в воздушно сухой почве через 3 часа при температуре +29-320С. При произвольном высушивании дитиленхи в клубнях выживают в условиях большой сухости, лишь небольшом количестве почвы.
Для нормальной активности нематод необходима пленочная влага и поэтому влажность почвы, относительная влажность и связанные с ними факторы внешней среды непосредственно влияют на выживаемость нематод (Wallace H.R., 1973).
Согласно с данными А.А. Устинова и Г.Н. Линника (1955) стеблевая нематода может инвазировать растения при кислотности рН 3,5-8,6. В кислых грунтах повреждений нематодами больше чем в щелочных. Так по данным Андреевой (1973) D. destructor наиболее подвижна при рН равном 4-5, а наименее активен при рН 10-11.
Нематоды рода Ditylenchus способны к длительному голоданию: D. dipsaci и D. destructor живут без пищи несколько недель, не теряя при этом способности к развитию и размножению (Тараканов В.И., 1975; Hodson W.E.H., 1931). По данным Костюк Н.А., (2004) при долгом отсутствии пищи стеблевая нематода картофеля способна впадать в анабиотическое состояние.
Такая приспосабливаемость D. destructor к абиотическим факторам и объясняет широкий ареал ее распространения и сложность методов защиты от нее.
Как указывает Kuhn H., 1959(a) основными источниками инвазии стеблевой нематоды служат почва и семенной материал. Кроме того, дитиленх способен развиваться и поддерживать свою популяцию на многих сорняках картофельного поля (T. Goodey, J.B. Goodey, 1949; Henderson, 1958; Рысс, 1962(б)), распространяться ирригационной водой (Губина, 1978; L.R. Faulkner, W.J. Bolander, 1966).
Выявление источников заражения клубней картофеля проводилось в полевых условиях на искусственном инвазионном фоне. Искусственный инвазионный фон создавали путем внесения кусочков дитиленхозной ткани в лунки при посадке (8-10 тыс. живых дитиленхов на 1 клубень). Высаживались пораженные стеблевой нематодой клубни в почву, свободную от инвазии и здоровые клубни в почву, предварительно инвазированную стеблевой нематодой. Было оценено 2747 клубней картофля.
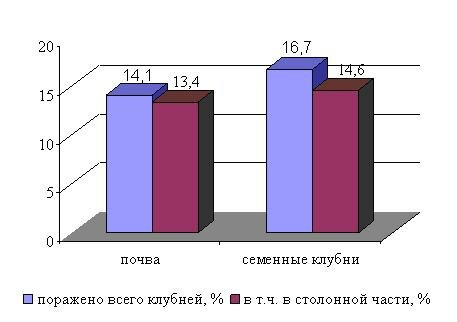
Из рисунка 15 видно, что и почва и материнский клубень являются источниками заражения клубней нового урожая. Так, в варианте с применением инвазированной почвы распространенность дителенхоза составила 14,1 %, в варианте с применением зараженного посадочного материала – 16,7 %. Почти все клубни были поражены стеблевой нематодой в столонной части. На основании этого нами сделан вывод, что основным путем проникновения инвазии в клубень является столон. Проникновение инвазии другими путями (чечевички, ранки) незначительно и составляет 0,7-2,1 % от общего числа учтенных клубней.
Рис. 15. Источники заражения клубней картофеля стеблевой нематодой D. destructor (опытное поле РУП «Институт картофелеводства НАН Беларуси», сорт Луговской, 2002-2004 гг.).
Литературные данные показывают, что D. destructor не является строгим монофагом. И при неблагоприятных условиях она может сохраняться на других растениях.
В жизни стеблевой нематоды растению как среде обитания отводится основная роль. Тут нематоды питаются, размножаются и полностью завершают свой жизненный цикл. Однако развитие и размножение дитиленхов в растительной среде в большой мере зависит от того, насколько подходит то или иное растение в качестве хозяина (Парамонов А.А., 1970; Иванова Б.П., 1971; Kuhn H., 1959(б)).
Wu Liang Yu (1960) считает, что дитиленхоз растений возникает лишь тогда, когда стеблевая нематода заселяет подходящего хозяина. В противном случае нематоды могут даже нести признаки морфофизиологического угнетения. Наблюдения показали, что D. destructor, выделенные из картофеля, имели большие размеры, чем из ириса.
Большие формы картофельного дитиленха были выявлены также при заражении настурции, чистеца, картофеля и мяты нематодами с картофеля, а также ириса с ириса, тогда как, например, при заражении с картофеля на мяту или с хмеля на ирис развиваются очень мелкие формы дитиленха. Кроме того, в зависимости от растения или устойчивости сорта наблюдали вариабельность репродуктивной системы (Goodey J., 1952; Bingefors S., 1961).
Под влиянием нового хозяина уменьшается длина гонады (Thorne G., 1961). Возможно, эти изменения объясняются различной пригодностью растений в качестве хозяев. Бингефош (1957) наблюдал сходные изменения длинны тела при развитии стеблевой нематоды на восприимчивых и устойчивых сортах клевера.
Изменение размеров тела и отдельных органов дитиленхов в зависимости от сорта, видовой принадлежности растения-хозяина и температуры окружающей среды наблюдали также Blake C.D., (1962a,b,c) и Caspary W. (1976).
По мнению большинства гельминтологов D. destructor имеет много растений-хозяев. Однако результаты полевых и лабораторных исследований слишком противоречивы.
Thorne (1945), который выделил стеблевую нематоду картофеля как самостоятельный вид указывает, что она встречается в США также на сахарной свекле, хмеле, мяте, гладиолусах, нарциссах, развиваясь лишь на подземных органах растений.
И.И. Корабу и Е.Ф. Терещенко (1954) не удалось заразить стеблевой нематодой картофеля рожь, овес, ячмень, кукурузу, просо, тимофеевку, клевер, гречиху и сахарную свеклу.
А.А. Устинов и Г.Н. Линник (1955) выявили стеблевую нематоду в полевых условиях на паслене черном. В лабораторных условиях нематодами из клубней картофеля удалось заразить чеснок, лук, овес, томаты, причем в дальнейшем в этих растениях происходит размножение и развитие нематод.
Р.Г. Рысс (1962(б)) отмечает, что картофельные дитиленхи при сильном заражении заселяли морковь, тыкву, баклажан синий, перец, причем в этих растениях нематоды повреждают в основном сочные подземные и нижние надземные части стеблей, которые находятся около корневой шейки. Кроме того, было установлено, что на корнеплодах моркови, которую выращивали на зараженных стеблевой нематодой делянках, появлялись рыхлые, белые язвы.
Согласно данным Н.А. Балашова (1965) и В.Н. Василевского (1974) стеблевая нематода в условиях Узбекистана повреждала морковь, лук, свеклу, пасленовые, люцерну, тыквенные, томаты, кукурузу, горох, лен. Единичные экземпляры нематод были найдены в растениях чеснока, фасоли, огурцов, земляники и лука. Совсем не повреждались рожь, пшеница, ячмень, овес, кормовая свекла, столовая свекла, салат, табак и капуста.
Dallimore C.E. и Thorne G. (1951) указывают на способность D. destructor поражать сахарную свеклу.
С.В. Капитоненко (1966) утверждает, что в условиях Прикарпатья стеблевая нематода картофеля развивается на следующих культурах полевого севооборота: гречиха, кормовые бобы, горох, люпин, морковь.
Исследования Basson S. (1991) показали, что стеблевая нематода может сохраняться в грунте с корневыми остатками арахиса.
Кроме того, установлено, что хозяином для стеблевой нематоды могут быть: горчица, редька, клевера, ревень, хмель, хлопок (V.E. Henderson, 1958; R. Dern, 1966; Foot M.A., Wood F.H., 1982; MacGuidwin A.E., Slack S.A., 1991; Moore, 1971б; Vlachopoulos E.G., 1994).
В Японии стеблевая нематода картофеля является серьезным вредителем чеснока (Fujimura T., Washio S., Nishizawa T., 1986).
В опытах Т.С. Скарбилович (1951) с использованием искусственного инвазионного фона не заразились роды сложноцветных, зонтичных и тыквенных. Это дает возможность предположить, что нематода D. destructor при благоприятных условиях может приспособиться для жизни не на всех овощных культурах.
Нематода D. destructor была выявлена на растениях паслена черного, подорожника, мяты полевой, осота полевого (T. Goodey, J.B. Goodey, 1949; Henderson, 1958; Рысс, 1962а; Ding Z., Lin M.S., 1982).
Стеблевая нематода картофеля способна поражать декоративные растения – георгины, гладиолусы, тюльпаны, ирисы, тигридии (H.H. Jensen, H.R. Smithson, L.B. Loring, 1958; Х. Деккер, 1972; Saigusa T., Aihara T., Nakatomi Y., 1977).
По данным Stefan (1997) сохранению стеблевой нематоды картофеля в почве способствуют: овес, люпин желтый, фасоль, лук-порей, томаты, цветная капуста, клевер красный, гречиха, кукуруза; из сорняков – осот полевой, ярутка полевая, одуванчик лекарственный, щавель полевой, мята перечная, подорожник ланцетолистный и бодяк полевой.
Р.Г. Рысс (1962б) считает, что при отсутствии своей основной кормовой культуры D. destructor может инвазировать и питаться и даже размножаться на других культурах. Поэтому необходимо придерживаться такого чередования культур в севообороте, при котором основная кормовая культура нематоды D. destructor чередовалась бы с неблагоприятными для нее культурами.
Moore (1971a) указывает на то, что источником инвазии могут служить оставшиеся в почве после предыдущей уборки пораженные стеблевой нематодой клубни картофеля.
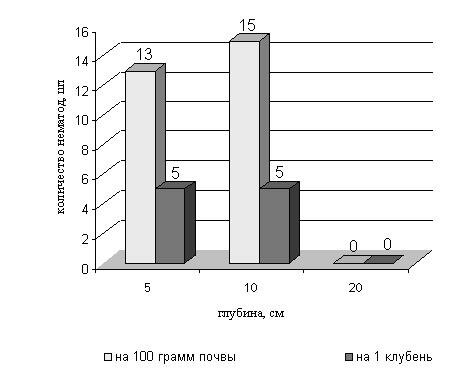
В условиях Беларуси установлена возможность сохранения стеблевой нематоды картофеля в клубнях, оставшихся после уборки в поле. Клубни картофеля, заложенные на разную глубину в почву на зимовку, оценивались в конце марта на наличие дитиленха. Обследовалась также почва вокруг клубней. Установлено способность D. destructor сохраняться в зимний период в клубнях картофеля на глубине до 10 см и в почве до 10 см. В клубнях, которые сгнили полностью, и в почве на глубине 20 см нематода не была выявлена (рис.18).
Следовательно, клубни картофеля оставленные во время уборки в поле и пораженные стеблевой нематодой могут являться источником инвазии для клубней нового урожая.
Рисунок 18 - Способность стеблевой нематоды картофеля к перезимовке в клубнях в поле.
Значение почвы как фактора среды, влияющего на развитие паразитических нематод растений, изучалось многими авторами, но единого мнения по этому вопросу нет. Большинство исследователей считает, что стеблевые нематоды не размножаются в почве и что почвенные популяции дитиленхов состоят из мигрирующих из растений нематод, и их численность в почве обусловлена численностью в растениях. Эти авторы склонны считать почву местом резервации фитогельминтов, в том числе и стеблевых нематод (Парамонов, Брюшкова, 1956; Lewis, Mai, 1960). Кирьянова (1961) почве как месту резервации нематод отводит второстепенное значение. Она считает, что в полевых условиях местом резервации для них являются различные растительные остатки, а в самой почве численность нематод относительно невелика.
|
Рисунок 16 - Стеблевая нематода картофеля |
Ditylenchus destructor Thorne, 1945
|
Рисунок 17 - Личинка D. destructor 2-го возраста в теле взрослой самки. |
Изучая влияние физических свойств почвы на дитиленхов, Nielson (1949) и Seinhorst (1950) установили, что нематоды, в частности D. dipsaci, настолько малы, что размеры почвенных пор не имеют значения в их распространении и борьбе с ними. В тоже время Norton (1959) показал, что скорость вылупления личинок увеличивается с увеличением размера пор, а Jones (1975), например, считает, что активность и подвижность нематод в почве находится в определенной зависимости от размера почвенных пор, толщины водной пленки, механического состава почвы, потребления кислорода контактирующими организмами и запаса питательных веществ. Wallace (1958) полагает, что размер почвенных пор способствует созданию в почве определенной влажности и таким образом опосредованно влияет на активность нематод. По его наблюдениям и Wilson (1930) от величины пор и порозности почвы зависит скорость движения D. dipsaci: в песчаной почве она была более высокой, чем в глинистой и суглинистой. Известно, что самую высокую активность нематоды проявляют во время и после дождей. В засушливый период водная пленка в почвенных порах бывает настолько тонка, что не может обеспечить нормальную подвижность обитающих в почве нематод.
Размер пор в значительной мере определяется механическим составом почвы, т.е. содержанием в ней отдельных механических фракций. Песчаные почвы, характеризующиеся более крупными порами и лучшей аэрацией, благоприятны для многих видов нематод. Однако большинство рас стеблевой нематоды D. dipsaci предпочитают тяжелые плодородные почвы и только ржаная и картофельная расы встречаются главным образом на легких почвах (Под общ. ред. В.Г. Губиной).
Влияние гранулометрического состава почвы на развитие и распространенность дитиленхоза на клубнях картофеля устанавливалось в вегетационном опыте (сорт Луговской). Клубни высаживались в вегетационные сосуды, наполненные разной по гранулометрическому составу почвой, с последующим внесением инвазии (суспензия нематод, 6-8 тыс. на 1 клубень).
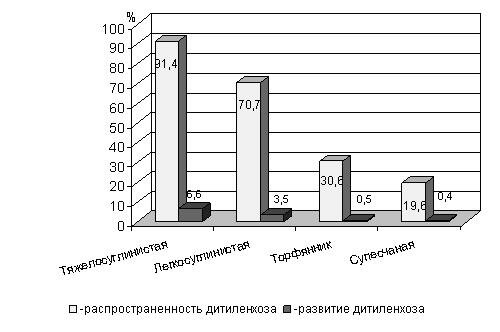
На рисунке 19 видно, что самое большое распространение и развитие заболевание получило в варианте с дерново-подзолистой тяжелосуглинистой почвой – 91,4 и 6,6 %, соответственно; наименьшее – в варианте с дерново-подзолистой супесчаной почвой (распространенность – 19,6 %, развитие – 0,4 %).
С изменением гранулометрического состава почвы, с уменьшением ее воздухопроницаемости и водопроницаемости, с увеличением влагоемкости почвы вредоносность дитиленхоза увеличивалась.
Рисунок 19 - Влияние гранулометрического состава почвы на поражаемость картофеля дитиленхозом.
Изучение в условиях полевого опыта влияния глубины и густоты посадки на проявление стеблевой нематоды картофеля показало, что эти агрохимические факторы не оказывают существенного влияния на поражаемость клубней картофеля дитиленхозом. Наибольшего развития заболевание достигло в вариантах с густотой посадки 35 см и глубиной посадки 12-15 см.
Таблица 4 – Влияние густоты и глубины посадки на проявление дитиленхоза картофеля (2002-2003 гг.)
|
Вариант |
P |
R |
|
Густота посадки |
||
|
20 см |
7,1 |
1,1 |
|
30 см |
9,8 |
1,5 |
|
35 см |
10,0 |
1,7 |
|
НСР0,05 |
7,6 |
1,8 |
|
Глубина посадки |
||
|
5-8 см |
7,7 |
1,4 |
|
12-15 см |
10,4 |
1,8 |
|
18-20 см |
8,8 |
1,6 |
|
НСР0,05 |
14,0 |
2,2 |
Примечание: P – распространенность болезни, %;
R – развитие болезни, %.
Читайте также
Поделиться!
Понравилась статья? Расскажите о ней знакомым или оставьте комментарий!
![]()
![]()
![]()
![]()
![]()
![]()
![]()